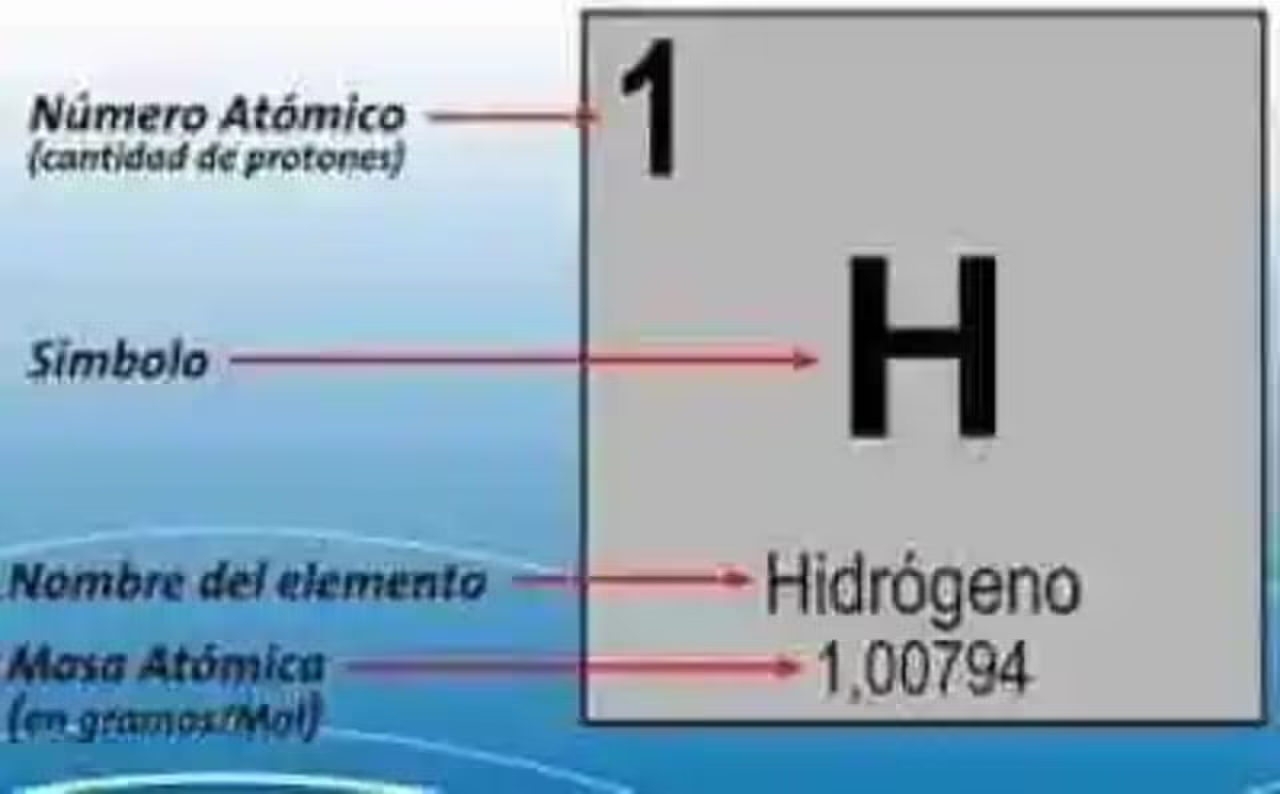
Grupos o Familias de la Tabla Periódica Actual
Esta categoría corresponde a cada una de las dieciocho columnas verticales que componen la Tabla Periódica. Se clasifican a su vez en diez grupos cortos y ocho grupos largos. Están ordenados en base al criterio de la valencia, es decir, todos los elementos de un grupo cuentan con la misma valencia, es decir, contienen el mismo número de electrones en la última capa, condición que les otorga propiedades químicas similares, y les concede en título de familia de Elementos. A continuación una breve descripción de cada grupo:
Grupo 1 (IA) metales alcalinos
Está conformado por el Litio (Li), el Sodio (Na), el Potasio (K), el Rubidio (Rb), el Cesio (Cs) y el Francio (Fr). Aunque el Helio forma parte gráfica de esta primera columna no pertenece a este grupo por ser un gas. Estos Elementos se caracterizan por presentar densidades muy bajas y ser buenos conductores de Electricidad.
Grupo 2 (IIA) familia de los metales alcalinotérreos
Este grupo está conformado por el Berilio (Be), Magnesio (Mg), Calcio (Ca), Estroncio (Sr), Bario (Ba) y el Radio (Ra). No obstante, a veces el Radio no es considerado parte de los Metales Alcalinotérreos, debido a que tiene un tiempo de vida corto. Esta familia se caracteriza por poseer dos electrones en la capa más externa, además de ser más duros y menos reactivos que los elementos del período anterior y poseer brillo. Son buenos conductores de electricidad.
Grupo 3 (IIIB) Familia Escandio
Está conformado por el Escandio (Sc), el Itrio (Y), Lantano (La), Lutecio (Lu), Actinio (Ac), Lawrencio (Lr). Se distinguen por presentar valencia 3. Así mismo son bastante reactivos y presentan tendencia a la oxidación. En cuanto a sus propiedades son similares a las del Elemento Aluminio.
Grupo 4 (IV B) Familia del Titanio
Se encuentra conformado por los Elementos Titanio (Ti), Circonio (Zr), Hafnio (Hf) y el Rutherfordio (Rf) aunque este último casi siempre no se clasifica en este grupo por ser un elemento radiactivo y sintético. Se caracterizan por ser pirofóbicos, es decir que al ser expuestos al aire hacen combustión.
Grupo 5 (VB) Familia del Vanadio
Este grupo se encuentra conformado por el Vanadio (V), Niobio (Nb), Tantalio (Ta), Dubnio (Db). Todos los elementos de este grupo se caracterizan por contar con valencia 5, es decir que todos cuentan con cinco electrones en la capa más externa.
Grupo 6 (VIB) Familia del Cromo
Está conformado por los Elementos Cromo (Cr), Molibdeno (Mo), Wolframio (W), Seaborgio (Sg). Estos elementos se caracterizan por presentar seis electrones en su capa externa, es decir, ser de valencia seis.
Grupo 7 (VIIB) Familia del Manganeso
Este grupo está conformado por los elementos Manganeso (Mn), Tecnecio (Tc), Renio (Re) y el Bohrio (Bh). Esta familia se caracteriza por contar con la valencia 7.
Grupo 8 (VIIIB) Familia del Hierro
Dentro de este grupo o familia se encuentran los Elementos del Hierro (Fe), el Rutenio (Ru), el Osmio (Os) y el Hassio (Hs). Todos corresponden a la valencia 8. Normalmente no se mención el Hassio cuando se habla de este grupo, por ser éste un Elemento que solo se consigue en el Laboratorio.
Grupo 9 (VIIIB) Familia del Cobalto
Este grupo se encuentra compuesto por el Cobalto (Co), Rodio (Rh), Iridio (Ir), Meitnerio (Mt). Se caracteriza por ser de valencia 9, además de ser todos sólidos mientras se encuentren a temperatura ambiente.
Grupo 10 (VIIIB) Familia del Níquel
Están conformados por los Elementos Níquel (Ni), Paladio (Pd), Platino (Pt), Darmstadtio (Ds). Se encuentran en la naturaleza en forma elemental, a excepción del Níquel el cual está catalogado como el más radiactivo de todos. A temperatura ambiente todos son sólidos. Todos son elementos de gran importancia en la industria, incluso algunos se usan para acuñar moneda, como por ejemplo el Níquel.
Grupo 11 (IB) Familia del Cobre
Este grupo está conformado por los elementos Cobre (Cu), Plata (Ag), Oro (Au) y Roentgenio (Rg). Se caracterizan por ser metales inertes y de difícil corrección, por lo que son usados frecuentemente para joyas, aunque no se aconsejan para acuñar monedas, pues son bastante blandos, por lo que deben someterse a aleaciones para hacer monedas resistentes.
Grupo 12 (IIB) Familia del Zinc
Este grupo está conformado por los Elementos Zinc (Zn), el Cadmio (Cd) y el Mercurio (Hg). Los tres elementos de esta familia se encuentran en la naturaleza. Los dos primeros son metales sólidos en condiciones ambientales normales, mientras que el Mercurio cuenta con la propiedad de ser un Metal en estado líquido aun en temperatura ambiente. Sin embargo, el Cadmio y el Mercurio son altamente tóxicos para el ser humano.
Grupo 13 (IIIA) Familia de los Térreos
También llamada Familia del Boro, está conformado por los Elementos Aluminio (Al), Galio (Ga), Indio (In) y Talio (Tl). Se distinguen por ser de valencia tres, y llevan el nombre de Térreo debido a que el Aluminio se encuentra en casi 75% de la tierra.
Grupo 14 (IVA) Familia de los Carbonoideos
Este grupo está conformado por los Elementos Carbono (C), Silicio (Si), Germanio (Ge), Estaño (Sn) y Plomo (Pb). Se distinguen por ser de valencia 4, es decir que cuentan con cuatro electrones en su última capa. Igualmente son bastante conocidos dentro del ámbito industrial y cotidiano. Igualmente, en la medida que aumenta su número atómico, se van convirtiendo cada vez más en elementos metálicos, pasando del Carbono que es un no metal al Plomo que es un Metal.
Grupo 15 (VA) Familia de los Nitrogenados
Se encuentran conformados por los elementos Nitrógeno (N), Fósforo (P), Arsénico (As), Antimonio (Sb), Bismuto (Bi) y el Ununpentio (Uup) elaborado sintéticamente. Se caracterizan por ser de valencia cinco y ser bastante reactivos.
Grupo 16 (VIA) Familia de los Calcógenos
También conocida como la Familia del oxígeno, se encuentra conformada por el Oxígeno (O), el Azufre (S), el Selenio (Se), el Telurio (Te) y el Polonio (Po). Algunos de sus elementos cuentan con las propiedades de formar compuestos de carácter básico o ácido. Todos son de valencia seis.
Grupo 17 (VIIA) Familia de los Halógenos
Este grupo se encuentra conformado por los Elementos Flúor (F), Cloro (Cl), Bromo (Br), Yodo (I), stato (At) y Ununseptio (Uus). Se caracterizan por ser de valencia seis y por ser elementos oxidantes.
Grupo 18 (VIIIA) Familia de los Gases Nobles
Este último grupo está conformado por los Elementos Helio (He), Neón (Ne), Argón (Ar), Kriptón (kr), el Xenón (Xe), el Radón 8Rn) y el Ununoctio (Uuo). Se caracterizan por tener valencia ocho y encontrarse en estado gaseoso. Así mismo son elementos no metálicos. Igualmente se les considera como Elementos Inertes.