Definición de Tabla Periódica
En el ámbito de las Ciencias Químicas, se conoce como Tabla Periódica al gráfico donde se encuentran dispuestos los distintos elementos químicos, descubiertos hasta ahora, los cuales están organizados de acuerdo a su número atómico, así como en cuanto a sus propiedades y características.
De acuerdo a la historia de la Química, el primer intento de clasificación y ordenación gráfica de los elementos químicos se le debe al químico ruso Dmitri Mendeléyev, quien tomó como criterio de clasificación las propiedades químicas de los elementos, específicamente la masa atómica de cada uno. En la misma época, el científico alemán Julius Lothar Meyer también propuso una forma de ordenar los elementos químicos, en contraste con Medeléyev se basó en las propiedades físicas de los elementos, tomando en cuenta el peso atómico de cada elemento.
No obstante fue el químico alemán Alfred Werner, quien basándose en los trabajos adelantados por Mendeléyev, diseñó la disposición o forma actual que tiene la Tabla Periódica. Algún tiempo después, en la década de los años cincuenta, el científico Gil Chaverri, de origen costarricense rediseñó la Tabla Periódica, proponiendo que los elementos se organizaran según su estructura electrónica, la cual permitía encontrar los elementos según su número atómico.
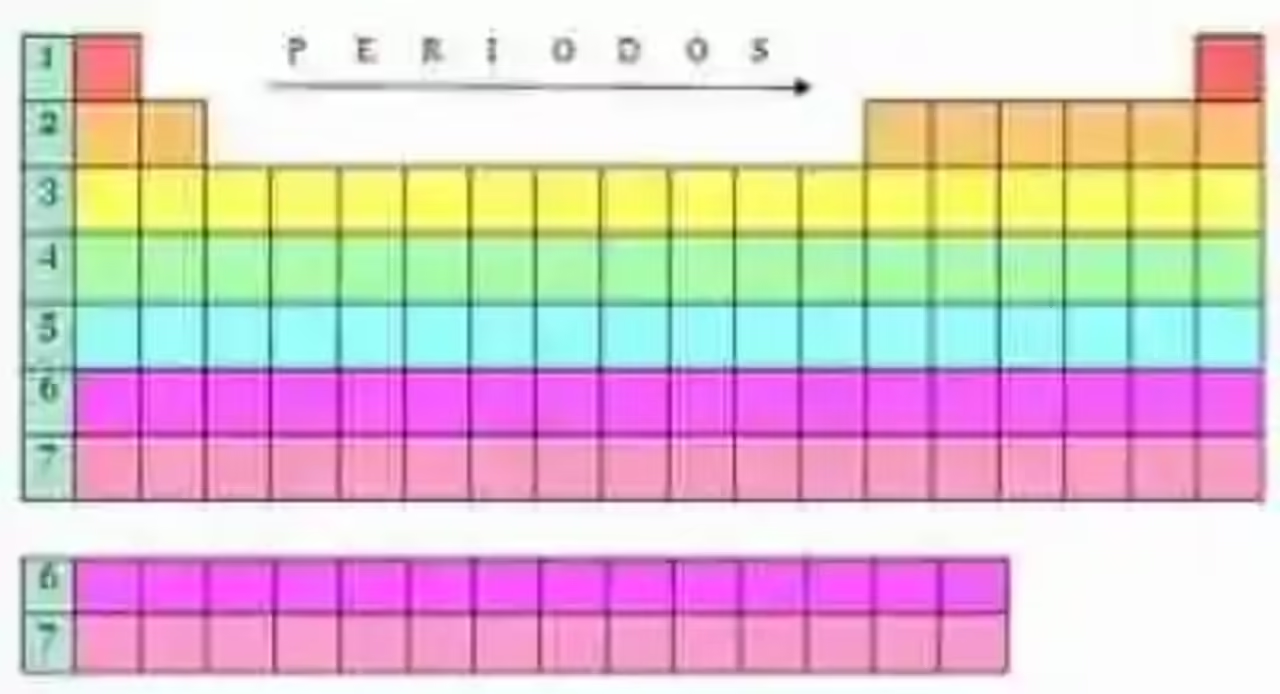
Desde entonces, los elementos químicos de la Tabla Periódica se encuentran agrupados en dieciocho (18) líneas verticales, que reciben el nombre de Grupos o Familias (ver más información en Ejemplos de familias o grupos de la Tabla Periódica), en siete líneas horizontales las cuales son llamadas Períodos (más detalles en Períodos que conforman la Tabla Periódica) y en cinco grandes bloques, teniendo cada uno de estas grandes parcelas de elementos sus propias características y criterios de agrupación.
A continuación entonces la definición de Bloque y el detalle de cada uno de los que existen dentro de la Tabla Periódica:
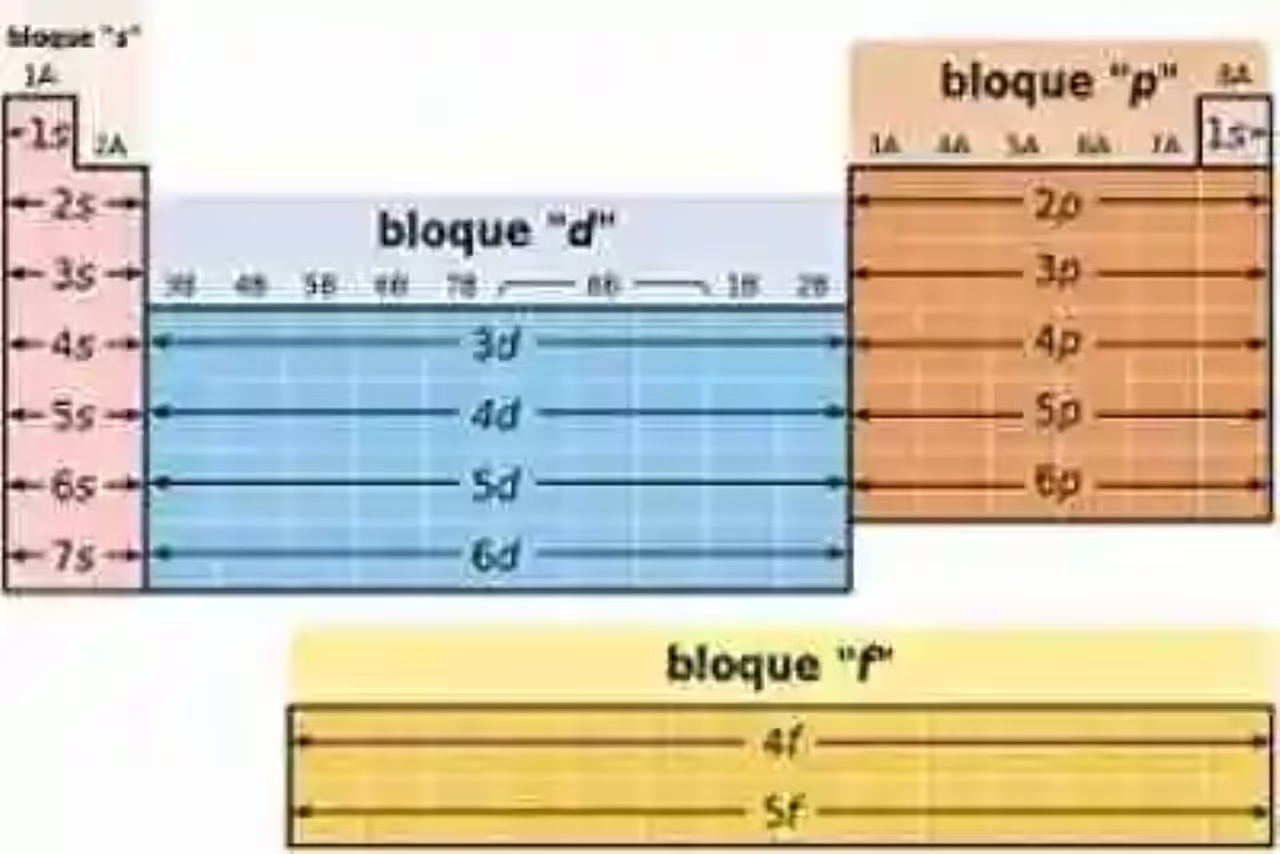
Bloques de la Tabla Periódica
En la actualidad, dentro de la Tabla Periódica se pueden distinguir –además de los dieciocho grupos y los siete períodos- cinco grandes bloques, lo cuales han sido identificados de acuerdo a los orbitales que ocupan los electrones más externos de un elemento específico, basándose en la ley científica conocida como Principio de Aufbau, la cual dicta cómo deben ubicarse los electrones en cada uno de los orbitales de un átomo.
En este sentido, estos bloques son nombrados en referencia al orbital donde se encuentran los átomos más externos del elemento en cuestión. De esta forma, dentro de la Tabla Periódica actual se pueden distinguir entonces los siguientes: bloque s, bloque p, bloque d, bloque f, y bloque g (el cual es hipotético, y se encuentra a la espera de elementos por descubrirse). Seguidamente se precisará cada uno de ellos:
Bloque S: dentro de este bloque se agrupan todos aquellos elementos cuyos electrones de valencia se encuentran ubicados en el orbital S. Así mismo estos elementos pertenecen a la primera y segunda columna de la Tabla Periódica, por lo que se circunscriben en el Primer y Segundo grupo (IA y IIA). Los elementos que forman parte de este bloque serían los siguientes:
- I A: Helio (He), Litio (Li), Sodio (Na), Potasio (K), Rubidio (Rb), Cesio (Cs) y Francio (Fr).
- II A: Berilio (Be), Magnesio (Mg), Calcio (Ca), Estroncio (Sr), Bario (Ba) y Radio (Ra).
Bloque P: dentro de este bloque se agrupan aquellos elementos químicos, cuyos electrones de valencia se encuentran situados en el orbital P, contando con una configuración electrónica equivalente a ns2px. De acuerdo a lo señalado por los textos químicos, los elementos pertenecientes a este bloque también se encuentran ubicados en los grupos o familias III A, IV A, V A, VI A, VII A y VIII A. Los elementos que pertenecen a este bloque son los siguientes:
- III A: Boro (B), Aluminio (Al), Galio (Ga), Indio (In) y Talio (Tl).
- IV A: Carbono (C), Silicio (Si), Germanio (Ge), Estaño (Sn) y Plomo (Pb).
- V A: Nitrógeno (N), Fósforo (P), Arsénico (As), Antimonio (Sb), Bismuto (Bi) y el Ununpentio (Uup).
- VI A: Oxígeno (O), el Azufre (S), el Selenio (Se), el Telurio (Te) y el Polonio (Po).
- VII A: Flúor (F), Cloro (Cl), Bromo (Br), Yodo (I), stato (At) y Ununseptio (Uus).
- VIII A: Helio (He), Neón (Ne), Argón (Ar), Kriptón (kr), el Xenón (Xe), el Radón 8Rn) y el Ununoctio (Uuo).
Bloque d: en este bloque se encuentran clasificados los elementos cuyos electrones de valencia se encuentran ubicados en el orbital d. De acuerdo a la literatura química, el bloque d se encuentra conformado por treinta elementos de la tabla periódica. No obstante, los científicos han señalado que en realidad existan más elementos con este tipo de valencia, sólo que se encuentran en estado libre en la naturaleza, y no son tomados en cuenta dentro de la clasificación química. Los elementos que conforman este bloque son los siguientes:
Titanio (Ti), Vanadio (V), Cromo (Cr), Manganeso (Mn), Hierro (Fe), Cobalto (Co), Níquel (Ni), Cobre (Cu), Cinc (Zn), Itrio (Y), Circonio (Zr), Niobio (Nb), Molibdeno (Mo), Tecnecio (Tc), Rutenio (Ru), (Rodio (Rh), Paladio (Pd), Plata (Ag), Cadmio (Cd), Lutecio (Lu), Hafnio (Hf), Tantalio (Ta) Wolframio (W), Renio (Re), Osmio (Os), Iridio (Ir), Platino (P), Oro (Au), Mercurio (Hg), Lawrencio (Lr), Rutherfordio (Rf), Dubnio (Db), Seaborgio (Sg), Bohrio (Bh), Hasio (Hs), Meitnerio (Mt), Darmstadtio (Ds), Roentgenio (Rg), Copernicio (Cn).
Bloque f: con respecto a los elementos pertenecientes a este bloque, es decir, cuyos electrones de valencia se encuentran en el orbital f, los químicos los han clasificado en dos series: lantánidos y actínidos. Dentro de este bloque se encuentran los siguientes elementos:
- Lantánidos: Lantano (La), Cerio (Ce), Praseodimio (Pr), Neodimio (Nd), Prometio (Pm), Samario (Sm), Europio (Eu), Gadolinio (Gd), Terbio (Tb), Disprosio (Dy), Holmio (Ho), Erbio (Er), Tulio (Tm), Iterbio (Yb) y Lutecio (Lu).
- Actínidos: Actinio (Ac), Torio (th), Protactinio (Pa), Uranio (U), Neptunio (Np), Plutonio (Pu), Americio (Am), Curio (Cm), Berkelio (Bk), Californio (Cf), Einstenio (Es), Fermio (Fm), Medelevio (Md), Nobelio (No) y Lawrencio (Lr).
Bloque g: de acuerdo a lo señalado por los químicos, este grupo sería un bloque hipotético, es decir, conformado por elementos aún no descubiertos, los cuales se creen además tendrían sus electrones de valencia dispuestos para un nuevo orbital. Se cree así mismo que este bloque podría empezar a partir del elemento químico hipotético Unbiunio (Ubu) que se cree contaría con el número atómico 121.
Fuente de imagen: wikipedia.org